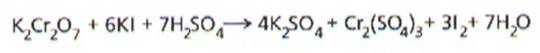Dioxidul de plumb, PbO2,
poate oxida acidul clorhidric la clor elementar conform ecuatiei:
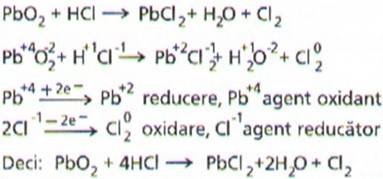
Se observa ca numai o
parte din acidul clorhidric este oxidat la clor elementar, restul reprezinta
mediul de reactie si are rolul de a reactiona cu ionii de plumb, Pb2+,
formand clorura de plumb.
Un cui de fier introdus in
solutie de sulfat de cupru se acopera cu un strat de cupru, procesul decurge
conform ecuatiei:
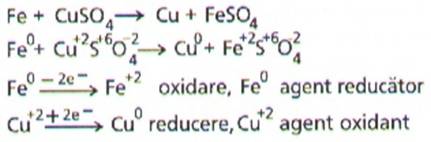
Se observa ca ionii sulfat nu participa in reactia
redox si ca atare ecuatia se poate scrie mai simplu astfel:
![]()
La egalarea unei ecuatii
redox, recomandam sa se respecte o anumita ordine, exemplificata in continuare
pentru reactia de oxidare a iodurii de potasiu, Kl, si cu dicromat de potasiu,
K2Cr2O7, in prezenta acidului sulfuric.
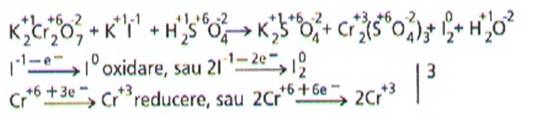
Se egaleaza:
1. elementele participante la procesele de oxidare si reducere (Cr si I)
![]()
2. celelalte metale (K)
![]()
3. nemetale, in afara de hidrogen si oxigen (S)
![]()
4. hidrogenul si apoi oxigenul