Numar de oxidare
Capacitatea de combinare a atomilor este bine
determinata de configuratia electronica a stratului exterior si este exprimata
prin notiunile chimice de valenta si numar de oxidare.
Numarul de oxidare al unui element este indicat
prin sarcina electrica pe care o are ionul sau intr-o combinatie ionica sau
prin sarcina formala pe care ar avea-o atomul daca, in mod conventional,
electronii pusi in comun ar fii total deplasati spre atomii mai
electronegativi.
Astfel, numarul de oxidare, notat prescurtat NO, se exprima printr-un numar
intreg pozitiv sau negativ si zero.
Numarul indica numarul de electroni cedati, acceptati sau pusi in comun de
un atom al elementului considerat.
Semnul „+” sau „-” indica sensul deplasarii totale sau partiale a electronilor
participanti la legatura si anume:
-
semnul „+” se utilizeaza pentru electronii
cedati sau electronii pusi in comun si deplasati de la atomul considerat spre
un alt atom mai electronegativ;
-
semnul „-” se utilizeaza pentru electroni
acceptati sau electroni pusi in comun sau deplasati spre atomul considerat.
Tinand seama de acest mod de exprimare a numarului
de oxidare, se pot stabili cateva reguli de determinare a numerelor de oxidare
ale atomilor dintr-o combinatie chimica.
a) Numarul de oxidare al hidrogenului este -1 in
compusii sai cu metale si +1 in compusii sai cu nemetale.
De exemplu:
- in hidrura de sodiu, NaH, NOH=-1 (un atom de hidrogen capteaza
un electron)
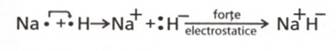
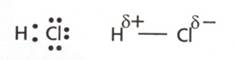 - in acid clorhidric, HCl, NOH=+1
(un atom de hidrogen pune in comun cu clorul un electron, ce este deplasat spre
atomul de clor)
- in acid clorhidric, HCl, NOH=+1
(un atom de hidrogen pune in comun cu clorul un electron, ce este deplasat spre
atomul de clor)
b) Numarul de oxidare al oxigenului este -2, cu
cateva exceptii, atat in compusii sai cu metale cat si in compusii sai cu
nemetale.
De exemplu:
- in oxidul de calciu, CaO, NOO=-2 (un atom de oxigen capteaza
doi electroni)
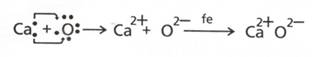
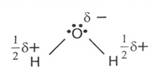
- in apa, H2O, NO=-2 (un atom de oxigen pune in comun cu
hidrogenul doi electroni, care sunt deplasati catre atomul de oxigen puternic
electronegativ)
c) Suma algebrica a numerelor de oxidare ale atomilor dintr-o specie
chimica neutra este egala cu 0.
Pe baza acestei observatii
se poate determina numarul de oxidare al unui element dintr-un compus dat. De
exemplu, in acid sulfuric, H2SO4, NOS= +6
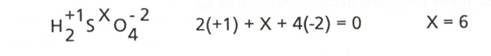
d) Suma algebrica a numerelor de oxidare ale atomilor dintr-un poliatomic
este egala cu sarcina ionului.
De exemplu, in ionul
sulfat neutru, SO42-, NOS= +6
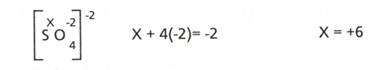
e) Pentru un electron pus in comun si nedeplasat se considera numarul de
oxidare 0.
De exemplu, in molecula de
clor, Cl2, NOCl=0 ( fiecare atom de clor pune in comun cu
celalalt atom de clor un electron, perechea de electroni pusi in
comun fiind uniform distribuita intre cei doi atomi).
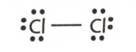
f) Substantele in stare elementara au numarul de oxidare 0.
De exemplu:
-
in
oxigenul molecular, 02, MOO=0
-
in
cuprul metalic, Cu, NOCu=0
g) Pentru determinarea numarului de oxidare al unui element dintr-un compus
cu structura cunoscut, se insumeaza:
-1 pentru fiecare sarcina negativa sau electron pus
in comun si deplasat spre atomul considerat;
0
pentru fiecare electron pus in comun
si nedeplasat;
+1 pentru fiecare sarcina pozitiva sau electron pus
in comun si deplasat de la atomul considerat spre alt atom mai electronegativ.
De exemplu:
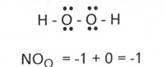 - in apa oxigenata, H2O, NOO=
-1
- in apa oxigenata, H2O, NOO=
-1
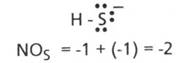
- in ionul sulfura acida, HS-, NOS= -2