Insa, in reactia:
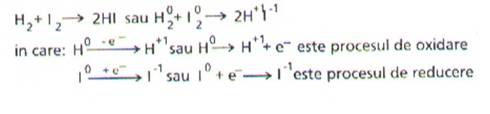
transferul de electroni de la atomii de hidrogen la atomii de iod este formal. In aceasta reactie, atomii de hidrogen nu cedeaza electroni si nu formeaza ioni pozitivi H+, iar atomii de iod nu accepta electroni si nu formeaza ioni negativi I-. Intre un atom de hidrogen si unul de iod se pune in comun o pereche de electroni ce este deplasata catre atomul de iod.
In vederea identificarii procesului de oxidare si a celui de reducere, a agentului oxidant si a celui reducator pentru o reactie redox, se determina, mai intai, numerele de oxidare ale elementelor ce intra in componenta reactantilor si a produsilor de reactie.
Presupunem pentru exemplificare urmatoarea reactie redox:

- Se determina numerele de oxidare ale atomilor.
![]()
- Se identifica elementele care isi schimba numerele de oxidare in timpul reactiei
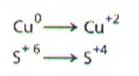
- Se identifica procesele de oxidare si de reducere, tinand seama ca in procesul de oxidare numarul de oxidare creste, iar in procesul de reducere numarul de oxidare scade.
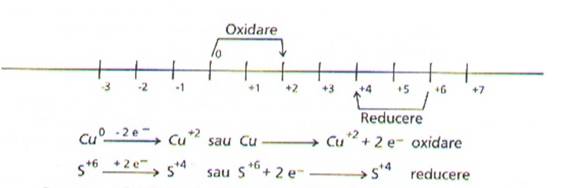
Presupunem sa utilizam, in continuare, pentru studiul reactiilor redox, prima varianta, in care transferul de electroni este trecut pe sageata, varianta care asociaza mai bine termenii:
- marirea numarului de oxidare -> oxidare -> cedare de electroni (-ne-);
- micsorarea numarului de oxidare -> reducere -> acceptarea de electroni (+ne-).
Se identifica agentul oxidant (specia care se reduce) si agentul reducator (specia care se oxideaza).

Multe din reactiile chimice intalnite in studiul chimiei organice si anorganice sunt reactii de oxido-reducere si multe dintrre ele au aplicatii practice.