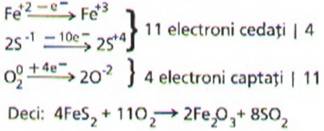Stabilirea coeficientilor in ecuatiile reactiilor redox
Pornind de la constatarea
ca intr-o reactie redox numarul de electroni cedati in procesul de oxidare este
egal cu numarul de electroni acceptati in procesul de reducere, studiul unei
reactii redox ajuta la egalarea ecuatiei.
Etapele unui astfel de
studio, exemplificat prin reactia dintre aluminiu si acidul clorhidric, sunt:
- determinarea numerelor de oxidare ale atomilor implicati in reactie:
![]()
- identificarea elementelor care isi schimba numarul de oxidare in timpul
reactiei:
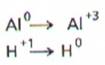
- identificarea procesului de oxidare si al celui de reducere, a agentului
oxidant si a celui reducator:

-amplificarea celor doua procese urmarind egalarea numarului de electroni
cedati cu numarul de electroni acceptati.
Observand ca din reactie
rezulta molecule de hidrogen formate din doi atomi de hidrogen, H2,
procesul de reducere se mai poate scrie:

-stabilirea coeficientilor ecuatiei pe baza analizei anterioare:
Sa analizam, in continuare, cateva reactii mai deosebite.
Cloratul de potasiu, KClO3,
se obtine din hipocrit de potasiu, KClO, prin incalzire, conform ecuatiei:
![]()
Urmarind etapele
prezentate anterior, studiem aceasta reactie redox:

Se observa ca aceeasi
specie chimica, clorul, cu numarul de oxidare +1, din hipocloritul de potasiu,
este si agentul oxidant si agentul reducator participand la un proces de
oxidare si la unul de reducere.
Astfel de reactii sunt
reactii disproportionate.
![]() In
unele reactii redox se pot intalni mai multe procese de oxidare sau de reducere
ca in reactia de oxidare a piritei, FeS2.
In
unele reactii redox se pot intalni mai multe procese de oxidare sau de reducere
ca in reactia de oxidare a piritei, FeS2.
Pirita este disulfura de
fier si contine ionul Fe2+ si ionul S22- cu
structura
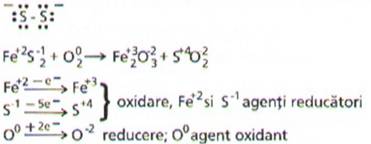
Tinand seama de formula
chimica a disulfurii de fier, si a moleculei de oxigen procesele se amplifica
astfel: